Chuyên đề Hóa học - Hợp chất Halogen
Câu 1: Trong phản ứng hóa học: Cl2 + Ca(OH)2 → CaOCl2 + H2O
Clo đóng vai trò
A. chất khử.
B. chất oxi hóa.
C. vừa là chất oxi hóa, vừa là chất khử.
D. không là chất oxi hóa, không là chất khử.
Câu 2: Dãy kim loại nào sau đây gồm các kim loại đều tác dụng được với dung dịch HCl?
A. Cu, Al, Fe
B. Zn, Ag, Fe
C. Mg, Al, Zn
D. Al, Fe, Ag
Câu 3: Cặp chất nào sau đây không tác dụng được với nhau?
A. Al và Br2
B. HF và SiO2
C. Cl2 và O2
D. F2 và H2
Bạn đang xem tài liệu "Chuyên đề Hóa học - Hợp chất Halogen", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Chuyên đề Hóa học - Hợp chất Halogen
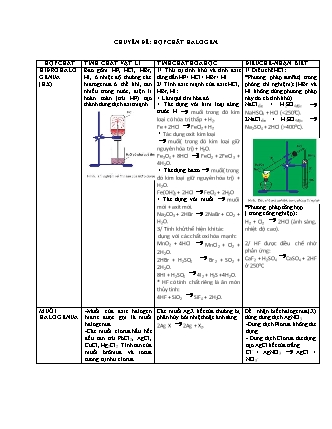
CHUYÊN ĐỀ: HỢP CHẤT HALOGEN. HỢPCHẤT TÍNH CHẤT VẬT LÍ TÍNHCHẤTHÓAHỌC ĐIỀUCHẾ-NHẬN BIẾT HIĐROHALOGENUA (HX) Bao gồm HF, HCl, HBr, HI, ở nhiệt độ thường các hiđrogenua ở thể khí, tan nhiều trong nước, điện li hoàn toàn (trừ HF) tạo thành dung dịch axit mạnh. 1/ Thứ tự tính khử và tính axit tăng dần HF< HCl< HBr< HI. 2/ Tính axit mạnh của axit HCl, HBr, HI: + Làm quì tím hóa đỏ + Tác dụng với kim loại đứng trước H muối trong đó kim loại có hóa trị thấp + H2. Fe + 2HCl FeCl2 + H2 + Tác dụng oxit kim loại muối( trong đó kim loại giữ nguyên hóa trị) + H2O. Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O. + Tác dụng bazơ muối( trong đó kim loại giữ nguyên hóa trị) + H2O. Fe(OH)2 + 2HCl FeCl2 + 2H2O + Tác dụng với muối muối mới + axit mới. Na2CO3 + 2HBr 2NaBr + CO2 + H2O. 3/ Tính khử thể hiện khi tác dụng với các chất oxi hóa mạnh: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O. 2HBr + H2SO4 Br2 + SO2 + 2H2O. 8HI + H2SO4 4I2 + H2S +4H2O. * HF có tính chất riêng là ăn mòn thủy tinh: 4HF + SiO2 SiF4 + 2H2O. 1/ Điều chế HCl: *Phương pháp sunfat( trong phòng thí nghiệm): (HBr và HI không dùng phương pháp này do có tính khử). NaClrắn + H2SO4đặc NaHSO4 + HCl (<2500C). 2NaClrắn + H2SO4đặc Na2SO4 + 2HCl (>4000C). *Phương pháp tổng hợp ( trong công nghiệp): H2 + Cl2 2HCl (ánh sáng, nhiệt độ cao). 2/ HF được điều chế nhờ phản ứng: CaF2 + H2SO4 CaSO4 + 2HF ở 2500C MUỐI HALOGENUA -Muối của axit halogen hiđric được gọi là muối halogenua. -Các muối clorua hầu hết đều tan trừ PbCl2, AgCl, CuCl, Hg2Cl2. Tính tan của muối brômua và iotua tương tự như clorua. Các muối AgX kết tủa thường bị phân hủy bởi nhiệt hoặc ánh sáng. 2Ag X 2Ag + X2. Để nhận biết halogenua(X-) dùng dung dịch AgNO3. -Dung dịch Florua không tác dụng. - Dung dịch Clorua tác dụng tạo AgCl kết tủa trắng. Cl- + AgNO3 AgCl + NO3- Tủa AgCl - Dung dịch Bromua tác dụng tạo AgBr kết tủa vàng nhạt. Br- + AgNO3 AgBr + NO3- - Dung dịch Iotua tác dụng tạo AgI kết tủa vàng đậm. I- + AgNO3 AgI + NO3- Tủa AgI AXIT HIPOCLORƠ (HClO)-MUỐI HIPOCLORIT - Là axit rất yếu, yếu hơn cả axit cacbonic: NaClO+CO2+H2ONaHCO3+HClO - Kém bền, chỉ tồn tại được trong nước: HClO HCl + O - HClO và muối của nó đều có tinh oxi hóa mạnh *Dung dịch của hỗn hợp muối NaCl( Natri clorua) và muối NaClO ( Natri hipoclorit) gọi là nước Javen, điều chế bằng cách: + PTN: cho khí clo tác dụng với dung dịch NaOH. 2NaOH + Cl2 NaCl + NaClO + H2O. + CN: điện phân dung dịch NaCl không có màng ngăn.: 2NaCl + 2H2O 2NaOH + Cl2 + H2. 2NaOH + Cl2 NaCl + NaClO + H2O. * Cloruavoâi :CaOCl2 laø muoái cuûa Ca vôùi 2 loaïi goác axit laø Cl- vaø ClO- muoái hoãn taïp. Laø muoái hoãn taïp: laø muoái cuûa 1 kim loaïi vôùi nhieàu loaïi goác axit khaùc nhau AXIT CLORIC (HClO3)-MUỐI CLORAT Là axit khá mạnh, tan nhiều trong nước, có tính oxi hóa mạnh. Muối kaliclorat(KClO3) được dùng làm thuốc nổ, diêm tiêu, được điều chế từ: 3Cl2 + 6KOH 5KCl+ KClO3 + 3H2O AXIT PECLORIC (HClO4) Là axit rất mạnh, tan nhiều trong nước. * Từ HClO, HClO2, HClO3, HClO4 tính axit và tính bền tăng, tính oxi hóa giảm. TRẮC NGHIỆM Câu 1: Trong phản ứng hóa học: Cl2 + Ca(OH)2 → CaOCl2 + H2O Clo đóng vai trò A. chất khử. B. chất oxi hóa. C. vừa là chất oxi hóa, vừa là chất khử. D. không là chất oxi hóa, không là chất khử. Câu 2: Dãy kim loại nào sau đây gồm các kim loại đều tác dụng được với dung dịch HCl? A. Cu, Al, Fe B. Zn, Ag, Fe C. Mg, Al, Zn D. Al, Fe, Ag Câu 3: Cặp chất nào sau đây không tác dụng được với nhau? A. Al và Br2 B. HF và SiO2 C. Cl2 và O2 D. F2 và H2 Câu 4: Trường hợp nào sau đây không xảy ra phản ứng hóa học? A. Cho I2 vào dung dịch NaBr. B. Cho Fe vào dung dịch HCl đặc, nguội. C. Sục khí Cl2 vào dung dịch NaBr. D. Sục khí Cl2 vào dung dịch FeCl2. Câu 5: Phát biểu nào sau đây là sai? A. Bán kính nguyên tử của clo lớn hơn bán kính nguyên tử của flo. B. Độ âm điện của brom lớn hơn độ âm điện của iot. C. Tính axit của HF mạnh hơn tính axit của HCl. D. Tính khử của ion I- mạnh hơn tính khử của ion Br-. Câu 6: Cho các phản ứng sau: (a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O (b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O (c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O (d) 2HCl + Zn → ZnCl2 + H2 Trong các phản ứng trên, số phản ứng trong đó HCl thể hiện tính khử là A. 3 B. 4 C. 1 D. 2 Câu 7: Thực hiện các thí nghiệm sau: (a) Sục khí Cl2 vào dung dịch NaOH. (b) Cho Al tác dụng với I2 có H2O làm xúc tác. (c) Cho MnO2 vào dung dịch HCl đặc, nóng. (d) Cho SiO2 vào dung dịch HF. Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là A. 1 B. 2 C. 3 D. 4 Câu 8: Cho 3,16 gam KMnO4 tác dụng với dung dịch HCl đặc (dư), sau khi phản ứng xảy ra hoàn toàn thì số mol HCl bị oxi hóa là A. 0,05 B. 0,16 C. 0,02 D. 0,10 Câu 9: Trong phòng thí nghiệm, nước Gia-ven được điều chế bằng cách A. điện phân dung dịch NaCl có màng ngăn. B. điện phân dung dịch NaCl không có màng ngăn. C. cho khí clo tác dụng với dung dịch NaOH. D. cho khí flo tác dụng cới dung dịch NaOH. Câu 10: Trong công nghiệp, nước Gia-ven được điều chế bằng cách A. điện phân dung dịch NaCl có màng ngăn. B. điện phân dung dịch NaCl không có màng ngăn. C. cho khí clo tác dụng với dung dịch NaOH. D. cho khí flo tác dụng với dung dịch NaOH. Câu 11: Phát biểu nào sau đây sai? A. Nước Gia-ven là dùng dịch hỗn hợp muối NaCl và NaClO. B. Clorua vôi là chất bột màu trắng, xốp, có tính oxi hóa mạnh. C. Nước Gia-ven dung để tẩy trắng vải, sợi và tẩy uế chuồng trại chăn nuôi, nhà vệ sinh. D. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit. Câu 12: Các axit : Pecloric, cloric, clorơ, hipoclorơ có công thức lần lượt là: A. HClO4, HClO3, HClO, HClO2. B. HClO4, HClO2, HClO3, HClO. C. HClO3, HClO4, HClO2, HClO. D. HClO4, HClO3, HClO2, HClO.. Câu 13: Dãy nào được xếp đúng thứ tự tính axit giảm dần? A. HClO, HClO3, HClO2, HClO4. B. HClO4, HClO3, HClO2, HClO. C. HClO, HClO2, HClO3, HClO4. D. HClO4, HClO2, HClO3, HClO. Câu 14: Clorua vôi, nước Gia-ven (Javel) và nước clo thể hiện tính oxi hóa là do A. chứa ion ClO-, gốc của axit có tính oxi hóa mạnh. B. chứa ion Cl-, gốc của axit clohiđric điện li mạnh. C. đều là sản phẩm của chất oxi hóa mạnh Cl2 với kiềm. D. trong phân tử đều chứa cation của kim loại mạnh. Câu 15: Clorua vôi là muối của kim loại canxi với 2 loại gốc axit là clorua Cl- và hipoclorit ClO-. Vậy clorua vôi gọi là muối gì ? A. Muối trung hoà. B. Muối kép. C. Muối của 2 axit. D. Muối hỗn tạp Câu 16: Ứng dụng nào sau đây không phải của KClO3 ? A. Sản xuất diêm. B. Điều chế oxi trong phòng thí nghiệm. C. Sản xuất pháo hoa. D. Chế tạo thuốc nổ đen. Câu 17: Cho MnO2 tác dụng với dung dịch HCl, toàn bộ khí sinh ra được hấp thụ hết vào dung dịch kiềm đặc, nóng tạo ra dung dịch X. Trong dung dịch X có những muối nào sau đây ? A. KCl, KClO. B. NaCl, NaOH. C. NaCl, NaClO3. D. NaCl, NaClO. Câu 18: Nhúng giấy quỳ tím vào dung dịch HCl, quỳ tím A. hóa đỏ. B. hóa xanh. C. không đổi màu. D. mất màu. Câu 19: Kim loại tác dụng với dung dịch HCl và tác dụng với khí Cl2 đều thu được cùng một muối là A. Fe B. Zn C. Cu D. Ag Câu 20: Trong phòng thí nghiệm có thể điều chế khí hidro clorua bằng cách A. Cho NaCl tinh thể tác dụng với H2SO4 đặc, đun nóng. B. Cho NaCl tinh thể tác dụng với HNO3 đăc, đun nóng. C. Cho NaCl tinh thể tác dụng với H2SO4 loãng, đun nóng. D. Cho NaCl tinh thể tác dụng với HNO3 loãng, đun nóng. Câu 21: Phát biểu nào sau đây sai? A. NaCl được dùng làm muối ăn và bảo quản thực phẩm. B. HCl là chất khí không màu, mùi xốc, ít tan trong nước. C. Axit clohidric vừa có tính oxi hóa, vừa có tính khử. D. Nhỏ dung dịch AgNO3 vào dung dịch HCl, có kết tủa trắng. Câu 22: Khi cho các chất: Ag, Cu, CuO, Al, Fe vào dung dịch axit HCl thì các chất đều bị tan hết là A. Cu, Al, Fe B. Cu, Ag, Fe C. CuO, Al, Fe D. Al, Fe, Ag Câu 23: Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là A. KNO3, CaCO3, Fe(OH)3 B. NaHCO3, AgNO3, CuO C. FeS, BaSO4, KOH D.AgNO3, (NH4)2CO3, CuS Câu 24: Phản ứng trong đó HCl thể hiện tính khử là A. HCl + NaOH → NaCl + H2O B. 2HCl + Mg → MgCl2 + H2 C. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O D. CaCO3 + 2HCl → CaCl2 + CO2 + H2O Câu 25: Cho các phản ứng sau: 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O 2HCl + Fe → FeCl2 + H2 3HCl + Fe(OH)3 → FeCl3 + 3H2O 6HCl + 2Al → 2AlCl3 + 3H2 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O Số phản ứng trong đó HCl thể hiện tính oxi hóa là A. 2 B. 1 C. 4 D. 3 Câu 26: Cho 23,7 gam KMnO4 phản ứng hết với dung dịch HCl đặc (dư), thu được V lít khí Cl2 (đktc). Giá trị của V là A. 6,72 B. 8,40 C. 3,36 D. 5,60 Câu 27: Cho 0,5 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 0,28 lít H2 (đktc). Kim loại đó là A. Ca B. Ba C. Sr D. Mg Câu 28:Hòa tan 2 gam một kim loại M thuộc nhóm IIA trong dung dịch HCl (dư). Cô can dung dịch, thu được 5,55 gam muối. Kim loại X là A. canxi B. bari C. magie D. beri Câu 29: Cho 7,8 gam hỗn hợp X gồm Al, Mg tác dụng với dung dịch HCl dư, thu được 8,96 lít H2 (đktc). Thành phần phần trăm khối lượng của Al trong X là A. 69,23% B. 34,60% C. 38,46% D. 51,92% Câu 30: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch HCl, thu được 1,344 lit hidro (đktc) và dung dịch chứa m gam muối. Giá trị của m là A. 5,23 B. 7 C. 7,48 D. 5,35 Câu 31: Hình vẽ dưới đây mô tả thí nghiệm điều chế khí hidro halogenua: Hai hidro halogenua (HX) có thể điều chế theo sơ đồ trên là A. HBr và HI B. HCl và HBr C. HF và HCl D. HF và HI Câu 32: Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl: Phát biểu nào sau đây sai? A. Có thể thay MnO2 bằng KMnO4 . B. Bông tẩm dung dịch NaOH ngăn không cho khí Cl2 thoát ra. C. Có thể thay dung dịch NaOH bằng dung dịch Ca(OH)2. D. Có thể thay dung dịch NaCl bằng dung dịch KOH. Câu 33: Cho vào ống nghiệm 1 ml dung dịch hồ tinh bột. Nhỏ tiếp một giọt nước iot vào ống nghiệm. Dung dịch thu được trong ống nghiệm A. không màu B. có màu đỏ C. có màu xanh D. có màu vàng Câu 34: Cho clo vào nước, thu được nước clo. Biết clo tác dụng không hoàn toàn với nước. Nước clo là hỗn hợp gồm các chất : A. HCl, HClO B. HClO, Cl2, H2O C. H2O, HCl, HClO D. H2O, HCl, HClO, Cl2 Câu 35: Cho 29,2 gam HCl tác dụng hết với KMnO4, thu được V lít khí Cl2 (đktc). Giá trị của V là A. 8,96 B. 17,92 C. 5,60 D. 11,20 Câu 36: Hoà tan khí Cl2 vào dung dịch KOH đặc, nóng, dư. Dung dịch thu được có các chất thuộc dãy nào dưới đây ? A. KCl, KClO3, Cl2. B. KCl, KClO3, KOH, H2O. C. KCl, KClO, KOH, H2O. D. KCl, KClO3. Câu 37: Thể tích dung dịch NaOH 1M để tác dụng hoàn toàn với 1,12 lít khí clo là: (đktc, Giả thiết thể tích dung dịch thay đổi không đáng kể) A. 100ml B. 50ml C. 500ml D. 200ml Câu 38: Cho phản ứng: NaX(rắn) + H2SO4 (đặc) to → NaHSO4 +HX(khí) Các hidro halogenua (HX) nào sau đây có thể điều chế theo phản ứng trên? A. HBr và HI B. HCl, HBr và HI C. HF và HCl D. HF, HCl, HBr và HI Câu 39: Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hóa hợp chất nào sau đây? A. NaCl B. HCl C. MnO2 D. KMnO4 Câu 40: Cho phương trình hóa học: aKMnO4 + bHCl → cKCl + dMnCl2 + eCl2 + fH2O Nếu a = 2 thì b bằng A. 16 B. 10 C. 5 D. 2 Câu 41: Cho các phản ứng sau: 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O 2HCl + CaOCl2 → CaCl2 + Cl2 + H2O 3HCl + Fe(OH)3 → FeCl3 + 3H2O 6HCl + 2Al → 2AlCl3 + 3H2 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O Trong các phản ứng trên, số phản ứng trong đó HCl thể hiện tính khử là A. 2 B. 1 C. 4 D. 3 Câu 42: Trong phản ứng hóa học: Cl2 + 2NaOH → NaCl + NaClO + H2O, A. Cl2 là chất khử, NaOH là chất oxi hóa. B. Cl2 là chất oxi hóa, NaOH là chất khử. C. Cl2 vừa là chất oxi hóa, vừa là chất khử. D. NaOH vừa là chất oxi hóa, vừa là chất khử. Câu 43: Phát biểu nào sau đây đúng? A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit. B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit. C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit. D. Clorua vôi không phải là muối. Câu 44: Dãy chất nào trong các dãy sau đây gồm các chất đều tác dụng được với dung dịch HCl ở điều kiện thường? A. Al, CuO, Na2SO4 B. Zn, Ag, CaCO3 C. Mg, MgO, AgNO3 D. Fe, Cu(OH)2, NaNO3 Câu 45: Thực hiện các thí nghiệm sau: Sục khí Cl2 vào dung dịch Ca(OH)2 Cho nước Br2 vào dung dịch KI Cho KMnO4 vào dung dịch HCl đặc, nóng Cho Na2CO3 vào dung dịch HCl Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là A. 1 B. 2 C. 3 D. 4 Câu 46: Cho sơ đồ chuyển hóa sau: Công thức của X, Y, Z lần lượt là A. Cl2, AgNO3, MgCO3 B. Cl2, HNO3, CO2 C. HCl, HNO3, NaNO3 D. HCl, AgNO3, (NH4)2CO3 Câu 47: Cho dung dịch chưa 14,6 gam HCl tác dụng hết với KMnO4, thu được V lít khí Cl2 (đktc). Giá trị của V là A. 4,48 B. 8,96 C. 2,80 D. 5,60 Câu 48: Hòa tan 9,6 gam một kim loại M thuộc nhóm IIA trong dung dịch HCl (dư). Cô cạn dung dịch, thu được 38 gam muối. Kim loại X là A. canxi B. bari C. magie D. beri Câu 49: Hòa tan hoàn toàn 16,1 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch HCl, thu được 6,72 lít hidro (đktc) và dung dịch chứa m gam muối. Giá trị của m là A. 26,15 B. 37,40 C. 14,96 D. 26 Câu 50: Để phân biệt hai lọ mất nhãn đựng dung dịch NaCl và dung dịch NaBr có thể dùng dung dịch nào trong các dung dịch sau đây? A. AgNO3 B. HCl C. NaOH D. KNO3
File đính kèm:
 chuyen_de_hoa_hoc_hop_chat_halogen.docx
chuyen_de_hoa_hoc_hop_chat_halogen.docx

